《江蘇省徐州市2022年中考化學復習 第2章 身邊的化學物質 課時訓練04 奇妙的二氧化碳練習》由會員分享���,可在線閱讀���,更多相關《江蘇省徐州市2022年中考化學復習 第2章 身邊的化學物質 課時訓練04 奇妙的二氧化碳練習(5頁珍藏版)》請在裝配圖網(wǎng)上搜索。
1���、江蘇省徐州市2022年中考化學復習 第2章 身邊的化學物質 課時訓練04 奇妙的二氧化碳練習
1.[xx·淮安] “綠色發(fā)展”“低碳生活”等理念逐漸深入民心。下列做法值得提倡的是 ( )
A.露天焚燒垃圾 B.回收和利用廢金屬
D.填埋廢舊電池 D.鼓勵私家車出行
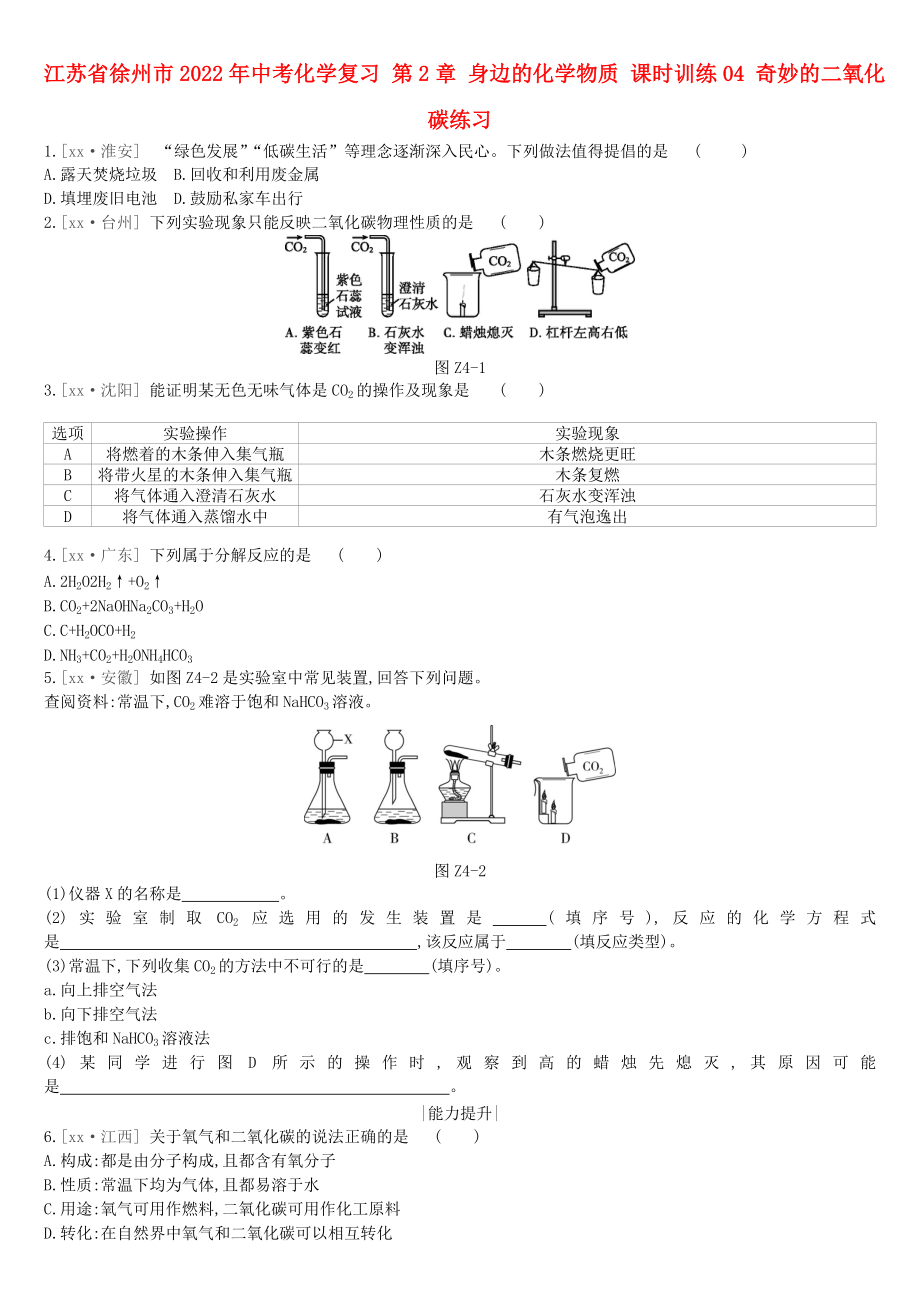
2.[xx·臺州] 下列實驗現(xiàn)象只能反映二氧化碳物理性質的是 ( )
圖Z4-1
3.[xx·沈陽] 能證明某無色無味氣體是CO2的操作及現(xiàn)象是 ( )
選項
實驗操作
實驗現(xiàn)象
A
將燃著的木條伸入集氣瓶
木條燃燒更旺
B
將帶火星的木條伸入集氣瓶
木條復燃
C
將氣體通入澄清石
2���、灰水
石灰水變渾濁
D
將氣體通入蒸餾水中
有氣泡逸出
4.[xx·廣東] 下列屬于分解反應的是 ( )
A.2H2O2H2↑+O2↑
B.CO2+2NaOHNa2CO3+H2O
C.C+H2OCO+H2
D.NH3+CO2+H2ONH4HCO3
5.[xx·安徽] 如圖Z4-2是實驗室中常見裝置,回答下列問題���。
查閱資料:常溫下,CO2難溶于飽和NaHCO3溶液。
圖Z4-2
(1)儀器X的名稱是 ���。?
(2)實驗室制取CO2應選用的發(fā)生裝置是 (填序號),反應的化學方程式是 ,該反應屬于 (填
3���、反應類型)。?
(3)常溫下,下列收集CO2的方法中不可行的是 (填序號)���。?
a.向上排空氣法
b.向下排空氣法
c.排飽和NaHCO3溶液法
(4)某同學進行圖D所示的操作時,觀察到高的蠟燭先熄滅,其原因可能是 ���。?
|能力提升|
6.[xx·江西] 關于氧氣和二氧化碳的說法正確的是 ( )
A.構成:都是由分子構成,且都含有氧分子
B.性質:常溫下均為氣體,且都易溶于水
C.用途:氧氣可用作燃料,二氧化碳可用作化工原料
D.轉化:在自然界中氧氣和二氧化碳可以相互轉化
7.[xx·濰坊] 如圖Z4-3是自然界中碳
4���、、氧循環(huán)簡圖(X為H2CO3,Y為C6H12O6)���。下列說法不正確的是 ( )
圖Z4-3
A.圖甲中的轉化1是酸雨形成的主要原因
B.圖乙中可實現(xiàn)有機物與無機物的相互轉化
C.綠色植物通過光合作用,將太陽能轉化成化學能
D.碳循環(huán)和氧循環(huán)有利于維持大氣中氧氣和二氧化碳含量的相對穩(wěn)定
8.碳和碳的化合物間的部分轉化關系如圖Z4-4所示���。
圖Z4-4
(1)物質X的化學式為 。?
(2)反應①的基本反應類型為 ���。?
(3)寫出物質X的一種用途: ���。?
(4)寫出該圖轉化關系中屬于化合反應的一個化學方程式:
5、 ���。?
(5)寫出反應②的化學方程式: ���。?
9.[xx·重慶A] (1)不同實驗對反應速率有不同要求。某同學探究CO2制取實驗,按要求答題。
限選控制反應速率的方法:
①反應物的濃度?��、诜磻锏臓顟B(tài)
限選試劑:
A.稀鹽酸 B.濃鹽酸 C.塊狀石灰石
D.碳酸鈉溶液 E.粉末狀石灰石
填寫下表并回答相關問題���。
實驗名稱
控制速率
的方法
所選用的
最佳試劑
滅火器反應原理
①
和D?
CO2的實驗室制法
?
A和C
寫出滅火器反應原理的化學方程式:
6、 ���。?
圖Z4-5
(2)已知:CO2和SO2既有相似性,又有差異性���。
實驗一:水槽中滴入紫色石蕊,將收集滿兩種氣體的試管同時倒立于其中,片刻后實驗現(xiàn)象如圖Z4-5所示,說明相同條件下的溶解性:SO2 (填“>”或“<”)CO2,試管內(nèi)溶液變成 色。?
實驗二:已知鎂條在CO2中劇烈燃燒的化學方程式為:2Mg+CO22MgO+C���。試推測鎂條在SO2中燃燒的現(xiàn)象為:劇烈燃燒, ���。 ?
10.[xx·來賓] 如圖Z4-6是實驗室制取純凈���、干燥的二氧化碳氣體,并探究其某些性質的實驗裝置���。據(jù)圖回答下列問題。
圖Z4-6
7���、
(1)D處應連接 (填“A”“B”或“C”)裝置���。?
(2)E裝置的作用是 ;用G裝置收集二氧化碳氣體,a端應連接G裝置 (填“b”或“c”)端���。?
(3)寫出H裝置中發(fā)生反應的化學方程式: 。?
11.[xx·宿遷] 某同學設計了如圖Z4-7所示的裝置,用于實驗室制取CO2,并對它的部分性質進行探究,按要求回答問題���。
圖Z4-7
(1)A裝置用于制取CO2,反應的化學方程式為 ���。?
(2)用B裝置收集CO2,氣體應從 (填“a”或“b”)端通入。?
(3)若要C
8���、中的兩個氣球懸浮在空氣中,則氣體甲可能是 (填序號)���。?
A.氫氣 B.氧氣 C.空氣
(4)往D試管中通入CO2,當出現(xiàn) 現(xiàn)象,表示石灰水中的溶質恰好完全沉淀。?
(5)E裝置的集氣瓶中充滿CO2,打開分液漏斗①,滴入少量NaOH濃溶液,氣球明顯脹大,寫出發(fā)生反應的化學方程式: ;若要氣球恢復原狀,應關閉分液漏斗①,打開分液漏斗②,滴入 (填化學式,忽略滴入液體體積)溶液���。
9���、
參考答案
1.B
2.D [解析] 紫色石蕊試液變紅色是因為二氧化碳能與水反應生成碳酸,A不符合題意;石灰水變渾濁是由于二氧化碳能與氫氧化鈣反應生成碳酸鈣沉淀,B不符合題意;蠟燭熄滅是因為二氧化碳不燃燒也不支持燃燒、密度比空氣大,C不符合題意;杠桿左高右低是因為二氧化碳的密度比空氣大,D符合題意���。
3.C [解析] 二氧化碳不能燃燒���、不能支持燃燒,既不能使燃著木條燃燒更旺,也不能使帶火星木條復燃;將氣體通入蒸餾水中,有氣泡逸出,不一定是二氧化碳,也可能是氫氣等���。
4.A
5.(1)長頸漏斗
(2)A CaCO3+2HClCaCl2+H2O+CO2↑
10、
復分解反應
(3)b?��。?)二氧化碳傾倒過快,先使高位蠟燭火焰附近氧氣濃度減小
[解析] 本題考查的是二氧化碳氣體的實驗室制取及其化學性質���。(1)由圖知,X儀器的名稱是長頸漏斗。(2)實驗室用石灰石(或大理石)與稀鹽酸反應制取二氧化碳氣體,反應物為固體和液體,反應條件為常溫,故可選用裝置A作發(fā)生裝置���。裝置B中長頸漏斗下端管口未液封,會使產(chǎn)生的二氧化碳逸出���。大理石(或石灰石)的主要成分是碳酸鈣,碳酸鈣與鹽酸發(fā)生反應生成氯化鈣、水和二氧化碳,發(fā)生反應的化學方程式為CaCO3+2HClCaCl2+H2O+CO2↑;該反應是碳酸鈣與鹽酸反應生成氯化鈣和碳酸,碳酸不穩(wěn)定,分解生成水和二氧化碳,故該
11���、反應為復分解反應。(3)CO2的密度大于空氣的密度,可用向上排空氣法收集;CO2難溶于NaHCO3飽和溶液,也可用排飽和NaHCO3溶液法收集���。(4)進行D所示的操作時,若二氧化碳傾倒過快,會先使高位蠟燭火焰附近氧氣濃度減小而熄滅���。
6.D [解析] 本題考查的是氧氣和二氧化碳的相關知識���。氧氣由氧分子構成,二氧化碳由二氧化碳分子構成,二氧化碳中不含有氧分子,故A錯誤;氧氣、二氧化碳常溫下都是氣體,氧氣不易溶于水,二氧化碳能溶于水,故B錯誤;氧氣無可燃性,不能作燃料,故C錯誤;在自然界中,動植物的呼吸���、含碳物質的燃燒都消耗氧氣生成二氧化碳,而植物的光合作用可將二氧化碳轉化為氧氣,故D正確���。
12、7.A [解析] 圖乙中是自然界中碳���、氧循環(huán)的重要反應,可實現(xiàn)有機物(葡萄糖)與無機物(二氧化碳)的相互轉化���。
8.(1)CO2 (2)分解反應
(3)工業(yè)上用來制汽水(答案合理均可)
(4)C+O2CO2(答案合理均可)
(5)CO2+Ca(OH)2CaCO3↓+H2O
9.(1)B?��、佗凇a2CO3+2HCl2NaCl+CO2↑+H2O
(2)實驗一:> 紅
實驗二:生成白色固體和黃色固體
[解析] (1)為了提高滅火的效率,滅火器中發(fā)生的反應速度要快,產(chǎn)生的二氧化碳氣體要多���。反應物的濃度越大,反應速率越快,且生成的氣體越多,所以,滅火器中的反應物應用濃鹽酸和碳酸鈉溶液
13、;實驗室制取二氧化碳氣體,為控制反應速率,可以控制反應物的接觸面積的大?��。捶磻锏臓顟B(tài))和反應物的濃度���。濃鹽酸和碳酸鈉溶液反應生成氯化鈉���、二氧化碳和水,反應的化學方程式為:Na2CO3+2HCl2NaCl+CO2↑+H2O。(2)實驗一:由圖中實驗現(xiàn)象可知,二氧化硫氣體溶解的比二氧化碳氣體多,證明相同條件下的溶解性是二氧化硫大于二氧化碳;二氧化硫溶于水生成亞硫酸,亞硫酸能使紫色石蕊試液變?yōu)榧t色���。實驗二:鎂條在二氧化碳中燃燒生成氧化鎂和碳,二氧化碳和二氧化硫的化學性質具有相似性,因此,鎂條在二氧化硫中燃燒的生成物是氧化鎂和硫單質,硫單質是黃色固體,所以,反應現(xiàn)象是劇烈燃燒,生成白色固體和黃色固
14���、體。
10.(1)C
(2)除去二氧化碳中的氯化氫氣體 c
(3)CO2+Ca(OH)2CaCO3↓+H2O
[解析] (1)因為濃鹽酸具有揮發(fā)性,實驗室不能使用濃鹽酸制取二氧化碳;稀硫酸與塊狀石灰石反應生成微溶于水的硫酸鈣,會覆蓋在石灰石表面,阻止反應的進行,也不能用于制取CO2���。(2)二氧化碳中會含有氯化氫和水蒸氣,應先用碳酸氫鈉溶液除去氯化氫,再用濃硫酸吸收水蒸氣,得到純凈���、干燥的二氧化碳。
11.(1)CaCO3+2HClCaCl2+H2O+CO2↑
(2)a?��。?)A
(4)溶液恰好由紅色變?yōu)闊o色
(5)CO2+2NaOHNa2CO3+H2O HCl或H2SO4
[
15���、解析] 本題主要考查實驗室制取二氧化碳的儀器裝置及反應原理。 (1)實驗室用大理石和稀鹽酸反應制取二氧化碳,反應方程式為CaCO3+2HClCaCl2+H2O+CO2↑���。(2)因為二氧化碳氣體的密度比空氣大,用B裝置收集CO2時,氣體應“長進短出”,因此,二氧化碳氣體應從a端通入���。(3)要使C中的兩個氣球懸浮在空氣中,應該充入密度小于空氣的氣體,氧氣的密度比空氣大,不符合要求,氫氣是密度最小的氣體,符合要求。(4)氫氧化鈣溶液呈堿性,能使酚酞溶液變紅,二氧化碳和氫氧化鈣反應,生成難溶于水的碳酸鈣沉淀和水,當氫氧化鈣恰好反應完時,溶液由紅色變?yōu)闊o色���。(5) 二氧化碳能和氫氧化鈉溶液反應生成可溶性的碳酸鈉和水,化學方程式為CO2+2NaOHNa2CO3+H2O;二氧化碳氣體減少,使瓶中氣壓減小,因此,氣球脹大,若要氣球恢復原狀,應使瓶中產(chǎn)生氣體,使瓶中氣壓增大,因此,應關閉分液漏斗①,打開分液漏斗②,滴入稀鹽酸或稀硫酸,使酸與碳酸鈉反應,產(chǎn)生二氧化碳氣體,使瓶中氣壓增大,氣球變小���。
 江蘇省徐州市2022年中考化學復習 第2章 身邊的化學物質 課時訓練04 奇妙的二氧化碳練習
江蘇省徐州市2022年中考化學復習 第2章 身邊的化學物質 課時訓練04 奇妙的二氧化碳練習