《高考化學(xué)二輪復(fù)習(xí)專項(xiàng)測(cè)試:專題十二 考點(diǎn)二 電解原理及其應(yīng)用 4含解析》由會(huì)員分享�,可在線閱讀,更多相關(guān)《高考化學(xué)二輪復(fù)習(xí)專項(xiàng)測(cè)試:專題十二 考點(diǎn)二 電解原理及其應(yīng)用 4含解析(9頁珍藏版)》請(qǐng)?jiān)谘b配圖網(wǎng)上搜索�。
1、
2020屆高考化學(xué)二輪復(fù)習(xí)專項(xiàng)測(cè)試專題十二
考點(diǎn)二?電解原理及其應(yīng)用(4)
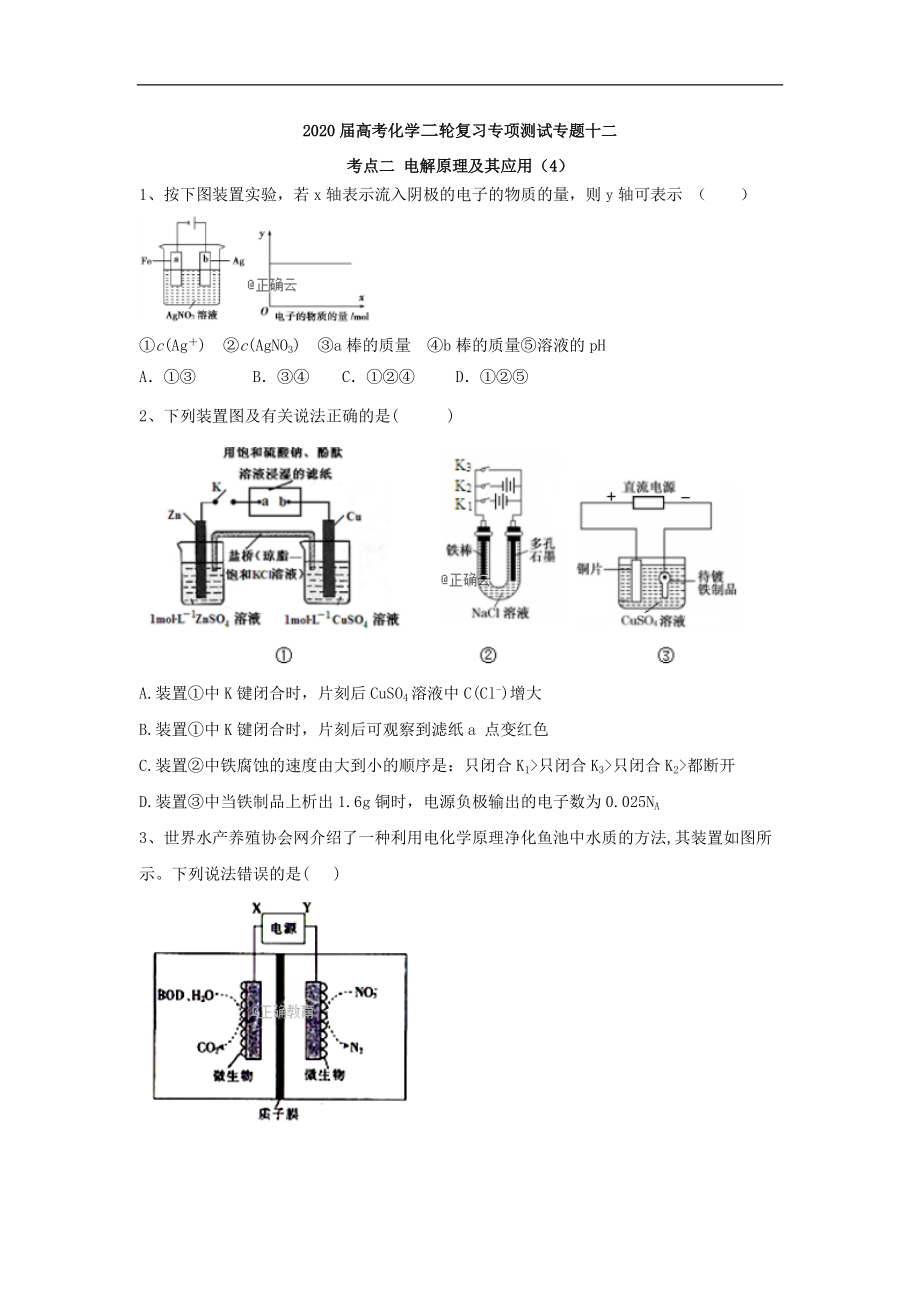
1�����、按下圖裝置實(shí)驗(yàn)�,若x軸表示流入陰極的電子的物質(zhì)的量���,則y軸可表示 ( )
①c(Ag+) ②c(AgNO3)?��、踑棒的質(zhì)量?����、躡棒的質(zhì)量⑤溶液的pH
A.①③ B.③④ C.①②④ D.①②⑤
2��、下列裝置圖及有關(guān)說法正確的是(?? ?)
A.裝置①中K鍵閉合時(shí)��,片刻后CuSO4溶液中C(Cl-)增大
B.裝置①中K鍵閉合時(shí)��,片刻后可觀察到濾紙a 點(diǎn)變紅色
C.裝置②中鐵腐蝕的速度由大到小的順序是:只閉合K1>只閉合K3>只閉合K2>都斷開
D.裝置
2����、③中當(dāng)鐵制品上析出1.6g銅時(shí)�,電源負(fù)極輸出的電子數(shù)為0.025NA
3、世界水產(chǎn)養(yǎng)殖協(xié)會(huì)網(wǎng)介紹了一種利用電化學(xué)原理凈化魚池中水質(zhì)的方法,其裝置如圖所示��。下列說法錯(cuò)誤的是(?? )
A.X為電源正極
B.若該裝置在高溫下進(jìn)行,則凈化效率將降低
C.若BOD為葡萄糖(C6H12O6),則1mol葡萄糖被完全氧化時(shí),理論上電極上流出24mol e-
D.若有1mol NO3-被還原,則有6mol H+通過質(zhì)子膜遷移至陰極區(qū)
4���、已知在為4~5的溶液中, 幾乎不水解,而幾乎完全水解�。某學(xué)生擬用電解溶液的方法測(cè)定銅的相對(duì)原子質(zhì)量。該同學(xué)向的含有雜質(zhì)的溶液中加入適量的黑色粉末,充分?jǐn)嚢韬?/p>
3�����、過濾,將濾液用下圖所示裝置電解,其中某電極增重,另一電極上產(chǎn)生標(biāo)準(zhǔn)狀況下的氣體�。下列說法正確的是( ????)
A.銅電極連接電源正極
B.銅的相對(duì)原子質(zhì)量的計(jì)算式是
C.黑色粉末是鐵粉
D.石墨電極上發(fā)生的反應(yīng)是
5、在下圖串聯(lián)裝置中���,通電片刻即發(fā)現(xiàn)乙裝置左側(cè)電極表面出現(xiàn)紅色固體�����,則下列說法不正確的是( ? ?)
A.標(biāo)準(zhǔn)狀況下當(dāng)甲中產(chǎn)生4.48L氣體時(shí),丙中Cu電極質(zhì)量增加21.6g
B. 電解過程中丙中溶液pH無變化
C. 向甲中加入適量的鹽酸,可使溶液恢復(fù)到電解前的狀態(tài)
D. 乙中左側(cè)電極反應(yīng)式:
6、是重要的溫室氣體,對(duì)地球溫室效應(yīng)的“貢獻(xiàn)”最大,如
4��、何利用是擺在科技工作者面前的重要課題�����。下圖所示電解裝置可將轉(zhuǎn)化為乙烯,該裝置的電解質(zhì)溶液為強(qiáng)酸性水溶液,電極材料為惰性電極�����。下列有關(guān)說法正確的是( )
A.a為電池的正極 B.電解過程中移向陽極
C.反應(yīng)前后溶液的pH保持不變 D.陰極反應(yīng)式:
7��、某工廠采用電解法處理含鉻廢水,利用耐酸電解槽陰陽極����,槽中盛放含鉻廢水,原理示意如圖��,下列說法不正確的是( )
A.a(chǎn)為電源正極
B.陽極區(qū)溶液中發(fā)生的氧化還原反應(yīng)為+6Fe2++14H+=2Cr3++6Fe3++7H2O
C.若不考慮氣體的溶解����,當(dāng)收集到H2 13.44L(標(biāo)準(zhǔn)狀況)時(shí),有0.2mol 被還原
D
5��、.陰極區(qū)附近溶液pH增大
8����、有通電條件下,用如圖所示裝置由乙二醛(OHC-CHO)制備乙二酸(HOOC-COOH),其反應(yīng)為:
�����。下列說法正確的是( )
A.Pt1的電極反應(yīng)為:
B.鹽酸起提供 和增強(qiáng)導(dǎo)電性的作用
C.每消耗0.1 mol乙二醛�����,在Pt1極放出2.24 L 氣體(標(biāo)準(zhǔn)狀況)
D.每得到1 mol乙二酸將有2 mol 從右室遷移到左室
9、電解法處理酸性含鉻廢水(主要含有)時(shí),以鐵板作陰�����、陽極,處理過程中存在反應(yīng),最后以形式除去�����。下列說法不正確的是(?? )
A.陽極反應(yīng)為Fe-2e-Fe2+
B.電解過程中溶液pH不會(huì)變化
C.過程中有Fe(OH)3
6����、沉淀生成
D.電路中每轉(zhuǎn)移12mol電子,最多有1mol?被還原
10、下列有關(guān)電化學(xué)裝置的說法正確的是(?? )
A.利用圖a裝置處理銀器表面的黑斑Ag2S,銀器表面發(fā)生的反應(yīng)為Ag2S+2e-=2Ag+S2-
B.圖b電解一段時(shí)間,銅電極溶解,石墨電極上有亮紅色物質(zhì)析出
C.圖c中的X極若為負(fù)極,則該裝置可實(shí)現(xiàn)粗銅的精煉
D.圖d中若M是海水,該裝置是通過"犧牲陽極的陰極保護(hù)法"使鐵不被腐蝕
11��、用如下圖所示的裝置進(jìn)行電解,通電一會(huì)兒,發(fā)現(xiàn)濕潤(rùn)的淀粉KI試紙的C端變?yōu)樗{(lán)色���。
1.E為電源的__________極,Fe為電解池的__________極����。
2.A中發(fā)
7����、生反應(yīng)的化學(xué)方程式為__________
3.在B中觀察到的現(xiàn)象是__________
4.Pt電極的電極反應(yīng)式為____________________�����。如電路中有0.2mol電子發(fā)生轉(zhuǎn)移,D端得到氣體的體積是________(標(biāo)準(zhǔn)狀況)。
12�、如圖是兩種溶液進(jìn)行電解的裝置。電極A是由金屬M(fèi)制成的���,M的硝酸鹽的化學(xué)式為M(NO3)2��,B���,C,D都是鉑電極�,P,Q是電池的兩極�,電路接通后,電極B上金屬有M沉淀出來�,
請(qǐng)回答下列問題:
(1)其中P是______極,B是______極�����。
(2)寫出A極��、B極��、C極、D極上的電極反應(yīng)式���。
A極上電極反應(yīng)式為___________
8����、_________________________________________��。
B極上電極反應(yīng)式為____________________________________________________��。
C極上電極反應(yīng)式為____________________________________________________����。
D極上電極反應(yīng)式為____________________________________________________。
(3)當(dāng)電路中通過2.408×1022個(gè)電子時(shí)�,B極上沉淀出1.28g M,則M的相對(duì)原子質(zhì)量為__________�。
(4)
9、如果將電池的正負(fù)極交換�,接入原電路通過1.204×1022個(gè)電子時(shí),則 B極上的電極反應(yīng)式為______________________���,A極上析出______ g ______(填物質(zhì)名稱),甲池的總反應(yīng)式為_______________________��。
13、某研究性學(xué)習(xí)小組將下列裝置如圖連接,C���、D�����、E��、F��、X�、Y 都是惰性電極��。將電源接通后,向乙中滴入酚酞試液,在F極附近顯紅色�����。試回答下列問題:
1.電源A 極的名稱是_________���。
2.甲裝置中電解反應(yīng)的總化學(xué)方程式是__________��。
3.如果收集乙裝置中產(chǎn)生的氣體,兩種氣體的體積比是__________�����。
10�、
4.欲用丙裝置給銅鍍銀,G應(yīng)該是__________(填“銅”或“銀”),電鍍液的主要成分是__________(填化學(xué)式)。
5.裝置丁中的現(xiàn)象是______________________�����。
答案以及解析
1答案及解析:
答案:D
解析:
2答案及解析:
答案:B
解析:A項(xiàng),K閉合時(shí),左邊Zn電極為負(fù)極,則Cl-移向ZnSO4溶液,A項(xiàng)錯(cuò)誤�。
B項(xiàng),a為陰極,b為陽極,在陰極上發(fā)生反應(yīng),則a點(diǎn)附近溶液呈堿性,溶液變紅,B項(xiàng)正確。
C項(xiàng),只閉合K1鐵作陽極,加速腐濁,只閉合K2鐵作陰極,被保護(hù),只閉合K3鐵作負(fù)極
11����、,加速腐蝕,則鐵腐蝕的速率由大到小的順序是:只閉合K1>只閉合K3>都斷開>只閉合K2,C項(xiàng)錯(cuò)誤.
D項(xiàng),根據(jù)電子守恒可知,負(fù)極輸出的電子數(shù)為,D項(xiàng)錯(cuò)誤。
3答案及解析:
答案:D
解析:試題分析:由圖中信息可知,與Y電極所連的電極上硝酸根離子被還原為氮?dú)?所以該電極為陰極��、Y為負(fù)極,則X為電源正極,微生物是催化劑���。A. 由圖可知,與Y電極所連的電極上硝酸根離子被還原為氮?dú)?所以該電極為陰極�����、Y為負(fù)極,則X為電源正極,A正確;B. 若該裝置在高溫下進(jìn)行,則微生物被滅活,凈化效率將降低,B正確;C. 若BOD為葡萄糖(C6H12O6),則1mol葡萄糖被完全氧化時(shí),C的化合
12��、價(jià)由0價(jià)升高到+4,理論上電極上流出24mole-,C正確;D. 若有1molNO3-被還原,由陰極的電極反應(yīng)式(2NO3-+10e-+12H+=N2↑+6H2O)可知,電子轉(zhuǎn)移只有5mol,所以有5molH+通過質(zhì)子膜遷移至陰極區(qū),D不正確���。本題選D����。
點(diǎn)睛:
本題考查了電解原理的應(yīng)用,要求我們能根據(jù)相關(guān)元素的化合價(jià)變化判斷其發(fā)生的反應(yīng)是氧化反應(yīng)還是還原反應(yīng),從而判斷電極的極性���。電解池的外電路上通過電子的電量與電解質(zhì)溶液中通過質(zhì)子交換膜的電量相等,不能根據(jù)實(shí)際消耗的氫離子數(shù)計(jì)算。
4答案及解析:
答案:D
解析:
5答案及解析:
答案:C
解析:
13��、
6答案及解析:
答案:D
解析:
7答案及解析:
答案:C
解析:
8答案及解析:
答案:B
解析:
9答案及解析:
答案:B
解析:電解時(shí),鐵作陽極,失去電子生成具有還原性的,將廢水中的還原為,同時(shí)本身被氧化為;B項(xiàng),電解過程中消耗,溶液的發(fā)生變化;C項(xiàng),電解過程中電離出的得電子, 增大, 與都與結(jié)合轉(zhuǎn)化為沉淀;D項(xiàng),由電極反應(yīng)式: ,每轉(zhuǎn)移12 生成6?,6?能夠還原1 �。
10答案及解析:
答案:A
解析:A項(xiàng),鋁作負(fù)極,Ag2S作正極得電子生成Ag,正確;B項(xiàng),銅電極連接電源負(fù)極,作陰極
14、,電極質(zhì)量增加,錯(cuò)誤;C項(xiàng),電解精煉銅時(shí),粗銅作陽極,應(yīng)連接電源的正極,錯(cuò)誤;D項(xiàng), “犧牲陽極的陰極保護(hù)法”利用的是原電池的工作原理,圖d裝置為電解池,錯(cuò)誤�����。
11答案及解析:
答案:1.負(fù); 陰; 2.4AgNO3+2H2O4Ag+4HNO3+O2↑
3.銅片溶解�,石墨電極上有氣體生成,溶液中有藍(lán)色沉淀生成
4.2H2O-4e-4H++O2↑?????? 2.24L
解析:
12答案及解析:
答案:(1)正�、陰
(2)M-2e- =M2+
M2+ +2e-=M
4OH- -4e-=2H2O+O2↑
2H+ +2e-=H2↑
(3)64
(4)4OH- -4e-=2H2O+O2↑、0.64�����、銅���、2Cu2+ +2H2O2Cu+O2↑+4H +
解析:
13答案及解析:
答案:1.正極; 2.2CuSO4+2H2O2Cu+O2↑+2H2SO4;3.1:1; 4.銀;AgNO3; 5.Y極附近紅褐色變深
解析:
 高考化學(xué)二輪復(fù)習(xí)專項(xiàng)測(cè)試:專題十二 考點(diǎn)二 電解原理及其應(yīng)用 4含解析
高考化學(xué)二輪復(fù)習(xí)專項(xiàng)測(cè)試:專題十二 考點(diǎn)二 電解原理及其應(yīng)用 4含解析