《新編高考化學(xué)二輪復(fù)習(xí) 專題五 化學(xué)實(shí)驗(yàn)基礎(chǔ) 第2講 化學(xué)實(shí)驗(yàn)方案與設(shè)計(jì)》由會(huì)員分享�,可在線閱讀,更多相關(guān)《新編高考化學(xué)二輪復(fù)習(xí) 專題五 化學(xué)實(shí)驗(yàn)基礎(chǔ) 第2講 化學(xué)實(shí)驗(yàn)方案與設(shè)計(jì)(8頁珍藏版)》請?jiān)谘b配圖網(wǎng)上搜索�����。
1��、新編高考化學(xué)備考資料
高效演練
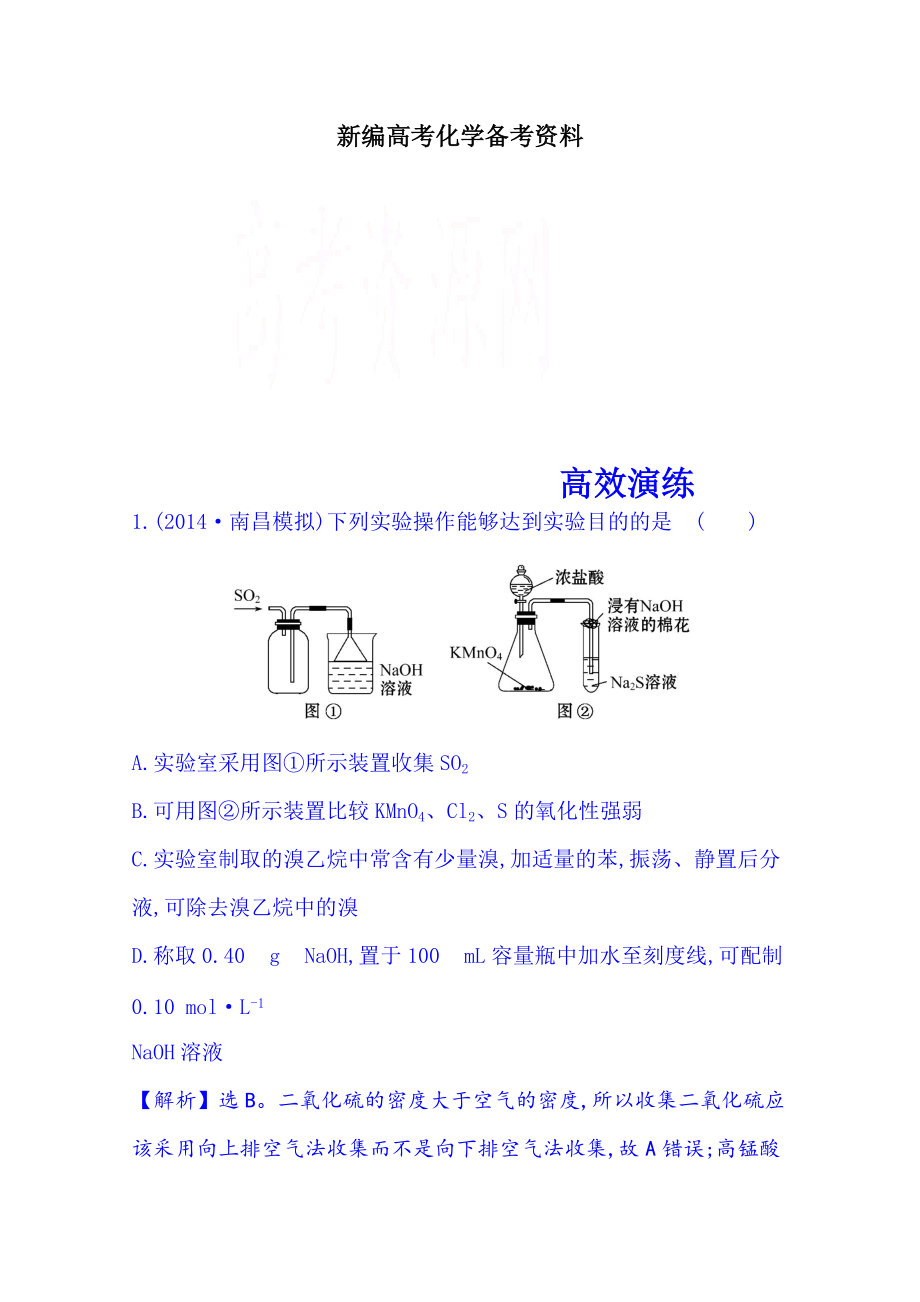
1.(2014·南昌模擬)下列實(shí)驗(yàn)操作能夠達(dá)到實(shí)驗(yàn)?zāi)康牡氖恰? )
A.實(shí)驗(yàn)室采用圖①所示裝置收集SO2
B.可用圖②所示裝置比較KMnO4�、Cl2���、S的氧化性強(qiáng)弱
C.實(shí)驗(yàn)室制取的溴乙烷中常含有少量溴,加適量的苯,振蕩、靜置后分液,可除去溴乙烷中的溴
D.稱取0.40 g NaOH,置于100 mL容量瓶中加水至刻度線,可配制0.10 mol·L-1
NaOH溶液
【解析】選B�����。二氧化硫的密度大于空氣的密度,所以收集二氧化硫應(yīng)該采用向上排空氣法收集而不是向下排空氣法收集,故A錯(cuò)誤;高錳酸鉀能氧化濃鹽酸生成氯氣,反應(yīng)中高錳酸鉀作氧化劑,
2�、氧化產(chǎn)物是氯氣,所以高錳酸鉀的氧化性大于氯氣,氯氣和硫離子反應(yīng)生成硫單質(zhì),氯氣是氧化劑,硫是氧化產(chǎn)物,所以氯氣的氧化性大于硫,由此得出高錳酸鉀的氧化性大于氯氣,氯氣的氧化性大于硫,故B正確;溴和溴乙烷都易溶于苯,所以不能采用分液的方法分離,故C錯(cuò)誤;容量瓶不能用來溶解氫氧化鈉固體,只能先把氫氧化鈉放在燒杯中溶解,等冷卻至室溫時(shí),再轉(zhuǎn)移至容量瓶中,故D錯(cuò)誤。
2.(2014·沈陽一模)為測定碳酸鈉的質(zhì)量分?jǐn)?shù)(設(shè)含雜質(zhì)碳酸氫鈉),某學(xué)生設(shè)計(jì)了如下實(shí)驗(yàn)方案,下列對實(shí)驗(yàn)方案的敘述正確的是 ( )
3.000 g 2.880 g
A.稱
3����、量所需要的儀器是托盤天平
B.樣品放在蒸發(fā)皿中灼燒
C.樣品中碳酸鈉的質(zhì)量分?jǐn)?shù)為0.76
D.如果灼燒后的樣品放在空氣中冷卻,會(huì)造成實(shí)驗(yàn)結(jié)果偏大
【解析】選D。托盤天平不可能精確到小數(shù)點(diǎn)后三位;灼燒應(yīng)放在坩堝中,而不是蒸發(fā)皿中;碳酸氫鈉受熱分解生成碳酸鈉,根據(jù)化學(xué)反應(yīng)方程式計(jì)算,求出碳酸鈉的質(zhì)量分?jǐn)?shù)為0.892;灼燒后的樣品放在空氣中冷卻,碳酸鈉吸水,會(huì)造成實(shí)驗(yàn)結(jié)果偏大����。
3.(2014·江南十校摸底)下述實(shí)驗(yàn)?zāi)苓_(dá)到預(yù)期目的的是 ( )
序號(hào)
實(shí)驗(yàn)內(nèi)容
實(shí)驗(yàn)?zāi)康?
A
向1 mL 2 mol·L-1NaOH溶液中滴入2滴0.1 mol·L-1MgCl2溶液,產(chǎn)生白色沉淀后,
4、再滴加2滴0.1 mol·L-1FeCl3溶液,又生成紅褐色沉淀
證明在相同條件下,溶解度
Mg(OH)2>Fe(OH)3
B
向混有BaCO3沉淀的NaOH溶液中滴入已知濃度的鹽酸(用酚酞作指示劑)
滴定其中NaOH含量
C
兩種一元堿溶液X和Y(X的pH比Y大1),分別加水稀釋100倍后,pH相等
證明稀釋前c(X)=10c(Y)
D
測定等物質(zhì)的量濃度的HF與HCl溶液的pH,后者較小
證明非金屬性Cl>F
【解析】選B��。堿過量均會(huì)沉淀,A錯(cuò)誤;鹽酸先與氫氧化鈉反應(yīng),當(dāng)指示劑變色時(shí)碳酸鋇沒有反應(yīng),B正確;稀釋前X的pH比Y大1,分別加水稀釋100倍后,pH相等說明
5���、Y比X弱,c(X)<10c(Y),C錯(cuò)誤;不能根據(jù)無氧酸酸性強(qiáng)弱比較非金屬性強(qiáng)弱,而且非金屬性F>Cl,D錯(cuò)誤。
4.(2014·西安模擬)下列有關(guān)實(shí)驗(yàn)現(xiàn)象和解釋或結(jié)論都正確的是 ( )
A.把二氧化硫通入紫色石蕊試液中,紫色褪去,說明二氧化硫具有漂白性
B.將少量的溴水分別滴入FeCl2溶液���、NaI溶液中,再分別滴加CCl4振蕩后靜置,下層分別呈無色和紫紅色,說明還原性:I->Br->Fe2+
C.某鉀鹽溶于鹽酸,產(chǎn)生無色無味氣體,通過澄清石灰水,有白色沉淀出現(xiàn),說明該鉀鹽是K2CO3
D.將充滿二氧化氮的密閉玻璃球浸泡在熱水中,紅棕色變深,說明反應(yīng)2NO2N2O4的ΔH<0
6���、【解析】選D���。二氧化硫與水反應(yīng)生成亞硫酸,把二氧化硫通入紫色石蕊試液中,紫色變?yōu)榧t色,而且顏色不會(huì)褪去,說明二氧化硫具有酸性氧化物的性質(zhì),與漂白性無關(guān),故A錯(cuò)誤;少量的溴水分別滴入FeCl2溶液、NaI溶液中,分別反應(yīng)生成鐵離子����、碘單質(zhì),不能比較亞鐵離子、碘離子的還原性,故B錯(cuò)誤;白色沉淀為碳酸鈣,氣體為二氧化碳,則鹽為碳酸鹽或碳酸氫鹽,則該鉀鹽是K2CO3或KHCO3,或二者都有,故C錯(cuò)誤;二氧化氮為紅棕色氣體,溫度越高,顏色越深,則2NO2N2O4為放熱反應(yīng),即ΔH<0,故D正確���。
5.(2014·蚌埠二模)僅用下表提供的儀器和藥品,就能達(dá)到相應(yīng)實(shí)驗(yàn)?zāi)康牡氖恰?
( )
編
號(hào)
7�����、儀器
藥品
實(shí)驗(yàn)?zāi)康?
A
托盤天平(帶砝碼)����、250 mL容量瓶�����、量筒���、燒杯�、藥匙、玻璃棒
NaOH固體�����、蒸餾水
配制250 mL一定物質(zhì)的量濃度的NaOH溶液
B
分液漏斗�、錐形瓶、燒杯����、導(dǎo)管及橡皮塞
稀硫酸、碳酸鈉�����、硅酸鈉溶液
證明非金屬性:S>C>Si
C
堿式滴定管�、酸式滴定管、膠頭滴管��、鐵架臺(tái)(帶鐵夾)����、錐形瓶
已知濃度的NaOH溶液��、待測鹽酸、蒸餾水�����、白紙
測定稀鹽酸的物質(zhì)的量濃度
D
鐵架臺(tái)(帶鐵夾)���、酒精燈���、大試管、集氣瓶���、導(dǎo)管及橡皮塞
氯化銨
制取氨氣
【解析】選B���。配制一定物質(zhì)的量濃度的溶液需容量瓶、膠頭滴管等儀器,A項(xiàng)缺少膠頭滴管,錯(cuò)
8����、誤;B正確;用氫氧化鈉溶液滴定鹽酸測鹽酸濃度,缺少指示劑,C錯(cuò)誤;用加熱法制取氨氣,應(yīng)該用氯化銨和氫氧化鈣固體混合加熱,因此D錯(cuò)誤。
6.單質(zhì)銅及其化合物一般都具有特殊的顏色,如:
Cu
Cu2O
CuO
Cu(OH)2
CuSO4·5H2O
紅色(或
紫紅色)
紅色
黑色
藍(lán)色
藍(lán)色
某學(xué)校研究性學(xué)習(xí)小組甲為檢測實(shí)驗(yàn)室用H2還原CuO所得紅色固體中是否含有Cu2O進(jìn)行了認(rèn)真的探究���。
Ⅰ.查閱資料得出下列信息:
①Cu2O屬于堿性氧化物
②高溫灼燒CuO生成Cu2O;
③Cu2O在酸性條件下能發(fā)生下列反應(yīng):
Cu2O+2H+Cu+Cu2++H2O���。
Ⅱ
9��、.設(shè)計(jì)實(shí)驗(yàn)方案:
方案1:取該紅色試樣溶于足量的稀硝酸中,觀察溶液顏色變化����。
方案2:取該紅色試樣溶于足量的稀硫酸中,觀察溶液是否呈藍(lán)色����。
方案3:稱得干燥坩堝的質(zhì)量為ag,取紅色試樣置于坩堝中稱得總質(zhì)量為bg,在空氣中高溫灼燒至質(zhì)量恒定,稱得最后總質(zhì)量為cg。
(1)寫出下列的化學(xué)方程式:
方案1中Cu2O參與的化學(xué)方程式:?
���。
方案2中Cu2O參與的化學(xué)方程式:?
10���、
。
(2)請你評(píng)價(jià)方案1和方案2的合理性,并簡述理由:
方案1:?
��。
方案2:?
11���、
�。
(3)方案3中,若確認(rèn)紅色粉末中含有Cu2O,則a��、b���、c應(yīng)符合的數(shù)學(xué)關(guān)系為 ,該實(shí)驗(yàn)方案最少得進(jìn)行__________次稱量����。
Ⅲ.研究性學(xué)習(xí)小組乙,設(shè)計(jì)了新的探究方案,擬通過干燥管中CuSO4是否變藍(lán)來判斷紅色固體中是否含有Cu2O,裝置如圖所示�����。
(4)簡述該探究方案中,檢驗(yàn)氣體發(fā)生裝置氣密性的方法(說明操作方法�����、現(xiàn)象和結(jié)論):?
12�、
。
(5)為確保探究的科學(xué)����、合理、安全,你認(rèn)為實(shí)驗(yàn)中還應(yīng)采取的措施有:
(填序號(hào))��。
A.在氫氣發(fā)生器與硬質(zhì)玻璃管之間加一個(gè)干燥裝置
B.加熱前先排盡裝置中的空氣
C.在盛有硫酸銅的干燥管后再連接一個(gè)裝有堿石灰的干燥管
【解析】方案1中因?yàn)橄∠跛峋哂醒趸?所以無法區(qū)分溶液中的Cu2+來自于銅被氧化,還是Cu2O被氧化;
方案2中因?yàn)橄×蛩釤o強(qiáng)氧化性,所以通過溶液中是否有紅色沉淀及溶液是否顯藍(lán)
13�����、色可以判斷紅色固體中是否含有Cu2O;
方案3是通過定量的方法來進(jìn)行判斷的,原理是4Cu+O22Cu2O,若(b-a)g全部是Cu,那么可以得到Cu2O的質(zhì)量為(b-a)g,若紅色固體中含有Cu2O,則存在關(guān)系:(b-a)g>(c-a)g,即8c<9b-a���。
答案:(1)3Cu2O+14HNO3(稀)6Cu(NO3)2+2NO↑+7H2O
Cu2O+H2SO4(稀)Cu+CuSO4+H2O
(2)不合理,因?yàn)殂~和氧化亞銅均可溶于稀硝酸形成藍(lán)色溶液
合理,因?yàn)檠趸瘉嗐~與稀硫酸生成Cu和Cu2+,導(dǎo)致溶液呈藍(lán)色
(3)8c<9b-a 4
(4)關(guān)閉導(dǎo)氣管上的活塞,從長頸漏斗中往試管中注水,漏斗中的液面高度高于試管中的液面高度,待一會(huì)兒,液面差不變,說明氣體發(fā)生裝置氣密性良好
(5)A��、B���、C
 新編高考化學(xué)二輪復(fù)習(xí) 專題五 化學(xué)實(shí)驗(yàn)基礎(chǔ) 第2講 化學(xué)實(shí)驗(yàn)方案與設(shè)計(jì)
新編高考化學(xué)二輪復(fù)習(xí) 專題五 化學(xué)實(shí)驗(yàn)基礎(chǔ) 第2講 化學(xué)實(shí)驗(yàn)方案與設(shè)計(jì)